L'acido carbonico
| L'acido carbonico | |
|---|---|
 | |
 | |
| Informazioni di identificazione | |
| Numero CAS Registry | 463-79-6 |
| ChemSpider | 747 |
| KEGG | C01353 |
| ChEMBL | CHEMBL1161632 |
| Proprietà | |
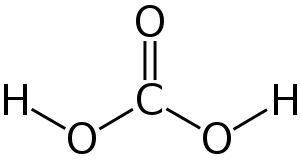
| Formula chimica | H 2 CO 3 |
| Massa molare | 62.03 g / mol |
| Densità | 1,0 g / cm 3(soluzione diluita) |
| Punto di fusione |
n / a
|
| Acqua alla solubilità | Esiste solo nella soluzione |
| Costante di dissociazione acida P Kun | 6.352 (P K A1 ) |
| Salvo diversamente specificato, i dati a temperatura ambiente (25 ° C ) - la pressione atmosferica è in (100 kPa). | |
Carbonati (carbonato, in inglese : acido carbonico ), la formula chimica H 2CO 3 rappresentato dal carbonio del oxo acido è un acido debole è una sorta di.
Natura [ Edit ]
Solitamente soluzione acquosa ( acqua gassata presente solo), l' acqua inanidride carbonica disciolta (la carbonatazione causata da questo).
Alcuni dell'anidride carbonica disciolta in acqua diventa carbonato mediante aggiunta di molecole di acqua.
Della reazione costante di equilibrio ( K h a 25) ° C e 1.7 × 10 in -3 è [1] La maggior parte del biossido di carbonio in soluzione acquosa per CO, è polarizzato verso sinistra significativamente 2 esiste come molecola.Catalizzatore se non esiste, la velocità con cui la reazione tra l'anidride carbonica e l'anidride carbonica per raggiungere l'equilibrio è bassa, la reazione forward costante di velocità è 0.039 s -1 a 23 s velocità costante, la reazione inversa -1 è.
Equilibrio anidride carbonica ed è molto importante nel regolare l'acidità dei fluidi, per la maggior parte dei microrganismi in modo da convertire il composto di due anidrasi carbonica avere. Questo enzima a 1 miliardo volte circa la velocità di reazione.
Carbonato provoca dissociazione delle due fasi in soluzione acquosa. P è il primo stadio della costante di dissociazione dell'acido a 25 ° C. K A1 = 3.60,2 stadio è P K a2 è a = 10,25, carbonato nella costante di dissociazione del veroacido acetico è un acido più forte, ma l'anidride carbonica e sopra per l'equilibrio esiste, pagg l'apparente K è un acido molto debole a * è alto. A causa di questo carbonato di corrispondenti di base spettacoli, liscivia di soda della vita quotidiana dai tempi antichi come la pulizia e sono stati utilizzati per.
Standard per dissociazione acida entalpia cambiamento, energia libera di Gibbs cambiamento, l'entropia valore della variazione è stata riportata [2] , una diminuzione di entropia accade a causa dissociazione degli ioni con l'aumento della carica idratazione grado di aumento , restringimento elettrico si verifica è acqua molecolare legame idrogeno grado di ordine da parte sia perché l'aumento di [3] . Questo valore p cosa all'equilibrio a seguito di K A1 è la costante di dissociazione apparente * acido.
,
,
| Prima di dissociazione | 7.64 kJ mol -1 | 36.34 kJ mol -1 | -96,3 J mol -1 K -1 | -377 J mol -1 K -1 |
|---|---|---|---|---|
| Seconda dissociazione | 14.85 kJ mol -1 | 58.96 kJ mol -1 | -148,1 J mol -1 K -1 | -272 J mol -1 K -1 |
Instabilità del carbonato [ Edit ]
Da tempo è stato considerato, può essere isolato a temperatura camera carbonato sé è impossibile. Tuttavia, NASA · nel 1991 Goddard Space Flight Center scienziati hanno per la prima volta puro H 2 CO 3 è stata in grado di produrre [4] .Alta energia anidride carbonica ed acqua sono stati congelati Essi radiazione dopo che è stato irradiato, sono stati isolati mediante eliminazione di acqua in eccesso mediante riscaldamento. Struttura del carbonica ottenuta spettroscopia infrarossa è stata considerata da. Dal momento che l'acqua ghiacciata e di biossido di carbonio è comunemente presente, questo esperimento si traduce in spazio i raggi cosmici o raggi ultravioletti , il che suggerisce che potrebbe esistere nello spazio e di acido carbonico è generato da che reagiscono con avere.
Da calcolo teorico, carbonato sarebbe indietro in anidride carbonica e acqua, non appena l'acqua è presente in una molecola, ma carbonato puro che non include l'acqua è stabile allo stato gassoso viene mostrato, l'emivita Si è stimato a circa 18 milioni anni [5] .
L'acqua piovana e di carbonato [ Edit ]
Il pH dell'acqua di anidride carbonica nell'atmosfera (0,033%) si è fuso in 5.6. Normale acqua piovana per non diventare saturo di anidride carbonica, il pH è intorno 6 Senza inquinanti atmosferici. Questo anidride solforosa il pH dell'acqua piovana è ridotta notevolmente da rifiuti industriali, quali pioggia acida diverso dal fenomeno. Tuttavia, l'acidità della pioggia gesso o calcare è un importante problemi geologici relativi ai minerali di carbonato come. E carbonato di calcio contenuto nel rocce bicarbonato di calcio tra l'equilibrio in soluzione viene stabilito il seguente.
Questo può portare grotte sotterranee linea di faglia in prossimità di acqua penetrata viene erosa. Il carbonato di calcio è precipitato ricchi di acqua evapora di calcio, spesso stalattiti e stalagmiti a formare. Composto da un gesso acquiferodi acqua carbonato di calcio di una grande quantità ha sciolto pompato da " acqua dura chiamata ".
Note a piè [ modifica ]
- ^ Welch, MJ, Lipton, JF; Seck, EN (1969) "Gli studi con traccianti radioattivi ossigeno-15 scambio tra anidride carbonica e acqua." .. J. Phys Chem .. 73 : 3351-3356 DOI:. 10.1021/J100844a033
- ^ DD Wagman, WH Evans, VB Parker, RH Schumm, I. Halow, SM Bailey, KL Churney, RI Nuttal, KL Churney e RI Nuttal, Le tabelle NBS di termodinamica chimica Proprietà, J. Phys. Chem. rif. dati 11 suppl. 2 (1982).
- ^ "base e 8 San base chimica Sensho" Shokabo Motoharu Tanaka, 1971
- ^ Moore, MH; Khanna, R. (1991) .. "Studi spettrale dell'infrarosso e la Messa di Proton irradiata Ice H2O + CO2: prova per acido carbonico" . Spectrochim Acta [A] 47 : 255-262.
- ^ Loerting, T.; Tautermann, C.; Kroemer, RT, Kohl, I.; Mayer, E.; Hallbrucker, A.; .. Leidl, KR (2000) "Sulla sorprendente stabilità cinetica di acido carbonico" Angew. chem, Int. Ed. ... 39 : 891-894 DOI:. 10.1002 / (SICI) 1521-3773 (20.000.303) 39:5 <891 :: AID-ANIE891> 3.0.CO; 2-E

